La technologie des cellules souches pluripotentes induites (iPS), une technique de reprogrammation cellulaire, vient de fêter ses trois ans au mois d’août [ 1]. On a de la peine à imaginer que cette approche qui a révolutionné le domaine des cellules souches soit si jeune ! La recette est simple : l’expression forcée des gènes Oct4, Sox2, Klf4 et cMyc par manipulation génétique ou par protéines recombinantes contraint une cellule différenciée tel un fibroblaste ou une cellule épithéliale à changer sa nature et à adopter un comportement de type cellule souche embryonnaire [ 2, 3]. C’est une technique parfaitement reproductible, ce qui explique sa diffusion dans les laboratoires. Cependant, on s’étonne que le pourcentage de cellules reprogrammées à chaque expérience soit si faible, de l’ordre de 0,05-0,5 % pour des fibroblastes embryonnaires de souris ou de 0,002-0,02 % pour des fibroblastes post-natals humains. Cette faible fréquence ne peut s’expliquer par la sélection de rares événements de mutagenèse insertionnelle puisque l’on peut obtenir des iPS par vecteur épisomique ou par protéines recombinantes [3, 4], ni par le ciblage d’une sous-population mineure de cellules souches immatures, puisque la reprogrammation de lymphocytes B matures ayant recombiné le locus des immunoglobulines est possible [ 5]. Une série exceptionnelle de cinq articles publiés dans la revue Nature vient montrer qu’un frein majeur à la reprogrammation, qui explique en partie le faible pourcentage de cellules reprogrammées, est la voie anti-oncogénique faisant intervenir P53 et INK4a [ 6– 10]. Le premier message de ces travaux est que le blocage de l’activité de P53 augmente considérablement le rendement de la reprogrammation : celui-ci atteint 80 % dans le contexte de la reprogrammation de fibroblastes murins embryonnaires (MEF) « secondaires » (c’est-à-dire issus eux-mêmes d’iPS primaires) par induction par la doxycycline des transgènes intégrés. Ces résultats sont transposables aux cellules humaines et l’efficacité de la reprogrammation de fibroblastes est augmentée d’un facteur 10 [10]. Une telle amélioration de la technologie de reprogrammation ouvre naturellement de nouvelles portes, et, par exemple, le blocage de P53 permet de reprogrammer un certain nombre de types cellulaires réfractaires à la méthodologie « standard » comme les lymphocytes T [ 7] ou les fibroblastes issus de souris déficientes en télomèrase hTert−/− de troisième génération [10]. Il permet également de raccourcir de manière spectaculaire le temps pendant lequel la surexpression des facteurs de reprogrammation exogènes est requise, passant de 8 jours à 3 ou 4 jours pour des MEF [ 9], ou de reprogrammer sans vecteur intégratif des cellules jusqu’à maintenant résistantes à ce type de reprogrammation plus délicate [7]. Le blocage de la voie P53 ne doit pas être permanent : son inhibition transitoire par l’utilisation de shARN (short hairpin) ciblant P53 pendant la reprogrammation suffit tout comme son inhibition indirecte par l’intermédiaire de protéines impliquées dans sa régulation, telles que MDM2 ou ARF [6, 7, 9, 10].
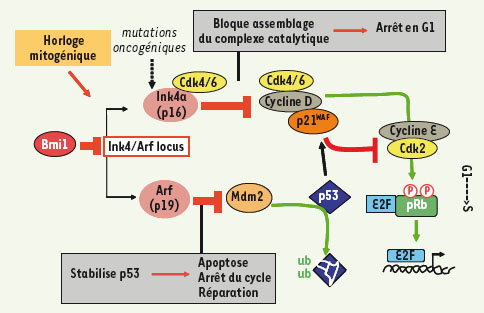
Le deuxième fortin qui empêche une cellule différenciée de se reprogrammer est justement les protéines codées par le locus Arf/Ink4a. Ce locus est une énigme génétique puisqu’il code, par épissage alternatif et par utilisation de cadres de lectures différents de l’exon 2, deux protéines très différentes, ARF et INK4a/P16, mais qui contrôlent positivement l’activité des deux gènes suppresseurs de tumeurs majeurs que sont respectivement P53 et la protéine du rétinoblastome (Figure 1). Ce locus est une véritable ligne Maginot dans la réponse antitumorale. On vient de voir que l’inactivation de ARF augmente considérablement l’efficacité de reprogrammation, par son action sur la voie P53. De même, l’inactivation de P16 par shARN augmente l’efficacité de reprogrammation, et l’inactivation simultanée d’ARF et P16 est synergique, son effet facilitant étant supérieur à l’inhibition de ARF ou P53 seule [6, 8, 9]. Mais puisque P53 et ARF-INK4a sont les piliers anti-tumoraux de la cellule, leur inactivation reste une action très risquée. C’est donc peu surprenant que l’on constate une activation de la voie de réponse aux dommages de l’ADN (DNA damage response, DDR) lorsque l’on bloque P53 au cours de la reprogrammation, avec accumulation de la forme phosphorylée du gène Atm (ataxia-telangiectasia-mutated), et accumulation de dommages ADN dont des fusions télomériques et des cassures chromosomiques [10].
À l’évidence, l’ensemble de ces observations construit des ponts entre le domaine des iPS et celui de la cancérologie. Dans les deux cas, p53 et le locus Arf/Ink4a sont des freins, frein à la dédifférenciation dans un cas, frein à la cancérisation dans l’autre. Un autre lien évident, et qui explique peut-être le premier point, est que la majorité des facteurs de reprogrammation (cMYC, OCT4, KLF4) sont des oncogènes ou sont surexprimés dans un grand nombre de cancers [ 11]. Il est tentant de faire un parallèle entre l’activation de la voie DDR observée au cours de la reprogrammation des fibroblastes p53−/− et celle induite par la surexpression d’oncogènes [10]. Ces résultats sont un pas en avant considérable dans la compréhension des barrières qui contrôlent la dédifférenciation. Mais, à l’heure actuelle, l’un des principaux obstacles à l’utilisation en clinique des iPS est le risque de tumeur - par la propriété intrinsèque des cellules pluripotentes à proliférer et par le risque de sélection de clones génétiquement anormaux. Il serait donc dangereux, même dans le but légitime d’améliorer la technique de la reprogrammation, de se laisser tenter à manipuler les gardiens du génome dans le cadre de la production d’iPS thérapeutiques.